猪源枯草芽孢杆菌 HEW -B113 的 鉴定及发酵工艺优化
尹望 杜志琳
(北京好实沃生物技术有限公司,北京 101399)
摘 要:研究从猪肠道中获得一株疑似枯草芽孢杆菌,通过形态特征、生理生化鉴定和 16S rDNA 分子 鉴定确定其为枯草芽孢杆菌,并采用液体发酵法,以发酵液中活菌数和芽孢数为指标,通过单因素试验和正 交试验对枯草芽孢杆菌 HEW - B113 的培养基和发酵条件进行优化。确定其最佳培养基配方为玉米淀粉 2%、 葡萄糖1%、豆粉1%、硫酸锰0. 2%和硫酸铁0. 15%; 最佳发酵条件为初始pH 7. 1、接种量0. 8%、发酵摇 瓶装液量100 mL/500 mL、转速200 r/min、发酵温度35 ℃及发酵时间40 h。采用枯草芽孢杆菌的最优发酵 工艺可以降低成本,提高质量,为枯草芽孢杆菌的扩大化生产提供理论依据。
关键词:枯草芽孢杆菌; 鉴定; 发酵工艺
虽然抗生素等添加剂能够有效预防畜禽疾病, 但抗生素的滥用引起病菌产生耐药性、环境污染及 药物残留等不利影响,加之人们对食品安全的要 求,近年来,欧洲已有许多国家禁止使用抗生素作 为饲料添加剂,各国学者着力于研究抗生素的理想 替代品。微生态制剂作为一种饲料添加剂,不仅能 够防病治病,促进动物生长,而且具有无污染、无 残留及无抗药性的特点,是抗生素无法比拟的。枯 草芽胞杆菌是常用微生态制剂之一,芽孢杆菌是一 类好氧或兼性厌氧菌,可产生芽孢,能够耐酸耐 碱、耐高温和高压,具有较高的稳定性。它们在动 物消化道内的繁衍及代谢,能够产生多种维生素、 氨基酸、有机酸、蛋白质和多种有效的酶等,参与 机体的新陈代谢,有助于动物对饲料中营养物质的 消化吸收,从而促进动物生长; 同时还具有生物颉 颃功能,通过消耗肠道中的游离氧来维持肠道的厌 氧环境,可以有效抑制动物肠道有害菌的繁殖,维 持消化道菌群平衡。目前市场上已有大量枯草芽孢杆菌微生态制剂,但大部分菌株都是从诸如土壤、 水和草地等自然环境中分离获得的。要想获得好的 枯草芽孢杆菌作为饲料添加剂,枯草芽孢杆菌必须经 过长期的进化、与动物形成共生关系及来源于动物肠 道内,才可以更好地适应动物的体内环境,从而发挥 更好的效果。研究主要从健康的猪体内分离出经过适 应猪肠道环境的枯草芽孢杆菌,并对其发酵工艺进行 优化,为微生态饲料添加剂的开发提供候选菌株。
1 材料与方法
1.1 材料
1.1.1 供试菌种 菌种 HEW - B113 分离筛选自猪肠道内容物, 按照常规方法在营养琼脂 ( NA) 培养基上培养。
1.1.2 主要试剂 细菌通用16S rDNA PCR 扩展引物27F 和1492R 由生物工程 ( 上海) 有限公司合成。TaqDNA 聚合酶 和 dNTP 购自生物工程 ( 上海) 有限公司。
1.1.3 主要仪器 T - 42K 型高速冷冻离心机 ( 德国 KONTRON 公司) ,MG48 + 型 PCR 仪 ( 杭州朗基科学仪器有限公司) ,GelDoc - It 200 型自动凝胶图像分析系统 ( Ultra - Violet ProductsLtd 公司) 。 1.1.4 培养基 菌落计数培养基 ( 牛肉膏蛋白胨固体培养基) : 牛肉膏 0. 3%,蛋白胨 1%,NaCl 0. 5%,琼脂粉 2%,pH 7. 2 ~7. 4; 种子培养基 ( 牛肉膏蛋白胨液体培养基) : 牛肉 膏0. 3%,蛋白胨1%,NaCl 0. 5%,pH 7. 2 ~7. 4; 基础发酵培养基: 葡萄糖 1%,蛋白胨 1%, MgSO4·7H2O 0. 1%,pH 7. 2 ~7. 4。
1.2 方法
1.2.1 菌株 HEW - B113 的鉴定 菌株 HEW - B113 的初步鉴定: 将菌株 HEW - B113 划线接种于 NA 固体平板培养基上,37 ℃恒 温培养18 ~24 h 后,观察记录活性菌株的单菌落形 态,主要包括菌落形状大小、菌落颜色、菌落水 分、菌落厚度和透明度等。革兰染色法观察菌株 HEW - B113 的细胞形态。将活化后的菌株 HEW - B113 接种于 LB 培养基中,37 ℃ 200 r/min 恒温振 荡培养12 h 后,用带膜的铜网蘸取少量菌液,放置 90 s,用滤纸将边缘液体吸干; 然后将带菌的铜网 放入烧杯中用 ddH2O 漂洗,取出带菌铜网并将液体 用滤纸吸干,再用 2%磷钨酸处理 3 ~ 5 min,样品 负染色完成后用电镜观察。 生理生化特征: 参照东秀珠的 《常见细菌系统 鉴定手册》和第八版 《伯杰系统鉴定手册》中的方 法进行活性菌株生理生化鉴定。 分子生物学鉴定: 菌株 HEW - B113 基因组 DNA 提取参照姜云等的方法,采用 CTAB 法提取。 利用 细 菌 16S rDNA 通 用 引 物 ( F27: 5 ' - AGAGTTTGATCCTGGCTCAG - 3 ',R1492: 5 ' - TACGGCTACCTTGTTACGACTT -3' ) 对菌株 HEW - B113 的16S rDNA 基因片段进行 PCR 扩增,PCR 扩 增体系 ( 25 μL) 包括引物27F 和1492R 各1. 0 μL, Taq DNA 聚合酶 1. 5 U,10 × Taqbuffer2. 5 μL, Mg2 + ( 25 mmoL/L) 1. 5 μL,菌株 HEW - B113 基 因组 DNA 50 ng。反应条件为 94 ℃预变性 5 min, 94 ℃ 变性40 s,54 ℃退火1 min,72 ℃ 延伸1 min 30 s,共30 个循环,72 ℃温浴 10 min。反应结束 后取3 μL PCR 产物在 1. 5% 琼脂糖凝胶上进行电 泳检测。所得 PCR 产物回收纯化,送中科院微生物 所进行 DNA 序列的测定。将所测得的序列与 GenBank 中的16S rDNA 序列进行 BLAST 分析比对,检 索相似的序列和系统发育相关的物种,随后用 MEGA 5. 0 软件构建系统发育树。
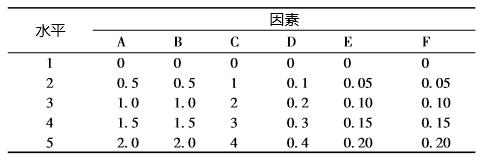
1.2.2 活菌和芽孢计数方法 活菌计数方法参照饲用微生物制剂中枯草芽孢 杆菌的检测 ( GB/T 26428———2010) 方法进行,将 培养完成的发酵液进行 10 倍倍比稀释至合适的稀 释度,取100 μL 稀释样液涂布平板,每个稀释度 做3 个重复,以平板上出现 30 ~300 个菌落数的稀 释度平板为计数标准进行活菌计数,根据稀释倍数计 算发酵液的含菌量。取培养完成后的发酵液10 mL 于 试管中,置于85 ℃水浴锅中恒温 10 min 后,取出 冷却,按照活菌计数方法测定处理后菌液中的细菌 总数,即为芽孢数。 1.2.3 种子液生长曲线的绘制 取活化后的 HEW - B113 转接 NA 试管斜面, 接种完成后置 37 ℃恒温培养 16 h。培养完成后, 取2 只试管斜面,分别加入 2 mL 无菌氯化钠注射 液制备成枯草芽孢杆菌菌悬液。将枯草芽孢杆菌菌 悬液接种于 NA 液体培养基中,接种量 1%,摇瓶 装液量100 mL/500 mL,接种完成后置于37 ℃恒温 振荡培养,摇床转速为200 r/min,每隔1 h 取出2 mL 测其活菌总数,绘制生长曲线。 1.2.4 培养基单因素试验 HEW - B113 培养基碳源、氮源和无机盐的优 化采用单因素试验。以基础培养基为发酵培养基, 分别用蔗糖、麦芽糖、可溶性淀粉、玉米淀粉、乙 酸钠和柠檬酸钠等量替换葡萄糖,分别测定发酵液 中活菌数和芽孢数获得最优碳源。然后以最优碳源 为碳源,无机盐和培养条件不变,分别用硝酸钠、 尿素、牛肉膏、酵母膏、氯化铵、豆粉、麸皮和硝 酸钾等量替换蛋白胨,分别测定发酵液中活菌数和 芽孢数获得最优氮源。在确定最优碳和氮源后,用 磷酸氢二钾、磷酸二氢钾、硫酸锰、硫酸镁、硫酸 铁、硫酸亚铁和硫酸锌等量的培养基中的 MgSO4· 7H2O,分别测定发酵液中活菌数和芽孢数获得最优 无机盐。 1.2.5 培养基正交试验 在单因素试验的基础上,确定了碳、氮源和无 机盐,通过预试验确定单因子的水平变化,因此以 检测发酵液中芽孢数 ( CFU) 为指标,选定 A ( 玉 米淀粉,g/100 mL) ,B ( 葡萄糖,g/100 mL) ,C
(豆粉,g/100 mL),D (酵母膏,g/100 mL),E ( 硫 酸锰,g/100 mL) ,F ( 硫酸铁,g/100 mL) 6 个因 素,设5 个水平进行正交试验 ( 见表1) 。试验重复3 次,检测方法同上,将3 次结果的平均值作为试验结 果,用SPSS 软件分析获得发酵最佳配方。
表1 HEW -B113 发酵培养基正交试验
1.2.6 培养条件的优化 在确定发酵培养基成分后测定不同培养条件下 发酵液中的活菌数和芽孢数。以发酵液中活菌数和 芽孢数为指标分别对接种量、发酵摇瓶装液量、转 速、初始 pH、发酵温度和发酵时间进行优化获得 最优发酵条件。
2 结果与分析
2.1 菌株 HEW - B113 鉴定结果 通过对菌株HEW -B113 形态特征观察 (见图1), 试验结果表明其在 NA 培养基上菌落呈污白色,菌落 不透明,表面水分较少且粗糙有褶皱,当液体静止培 养时能形成皱醭; 通过光学显微镜和电子显微镜观察 发现,菌株 HEW - B113 为革兰阳性杆菌,无荚膜, 周生鞭毛,具有运动性,能产生椭圆形芽孢。 通过生理生化鉴定获得菌株 HEW - B113 的生理 生化特征,从表 2 可见: 菌株 HEW - B113 能耐受 7%NaCl,45 ℃下生长良好,4 ℃下不能生长,能利 用柠檬酸盐,不能利用丙二酸盐,V - P 为阳性,并 能利用多种糖醇产酸。生理生化与模式枯草芽孢杆 菌比较可以鉴定菌株 HEW -B113 为枯草芽孢杆菌。
表2 菌株 HEW -B113 主要生理生化鉴定结果
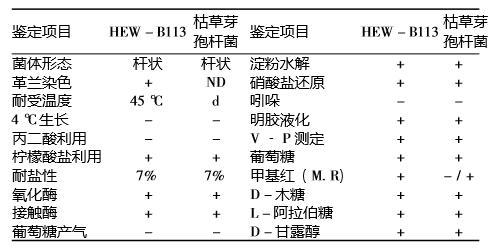
注: 表中“ND”表示未测定, “d”表示 11% ~ 89% 菌株为阳性, “- ”表示阴性,“+ ”表示阳性。
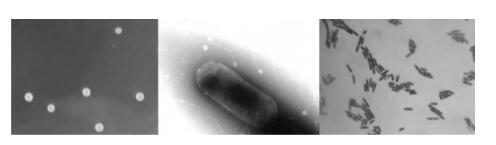
注: 从左到右依次为单菌落形态、细胞形态和革兰染色形态HEW - B113
图1 HEW - B113 菌株的形态特征
利用细菌通用引物27F 和1492R 扩增获得枯草 芽孢杆菌的 16S rDNA 片段,片段大小在 1 500 bp 左右 ( 见图2) ,测序获得菌株 HEW - B113 的 16S rDNA 序列,其长度为 1 419 bp。将获得的序列用 MEGA5. 0 构建系统进化树 ( 见图3) 进行序列比较 分析,可以看出 HEW - B113 与枯草芽孢杆菌聚于 同一分支中,其同源性分别达到99%。通过菌株 HEW - B113 的形态特征、生理生化反应和分子特 征,鉴定菌株 HEW - B113 为枯草芽孢杆菌。登录 号为 KF849801。
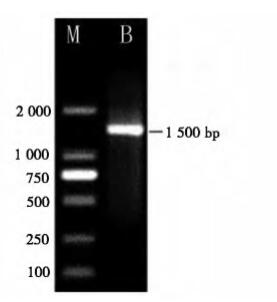
注: B HEW - B113,M DL2000 Marker。
图2 菌株 HEW - B113 16S rDNA PCR 扩增结果
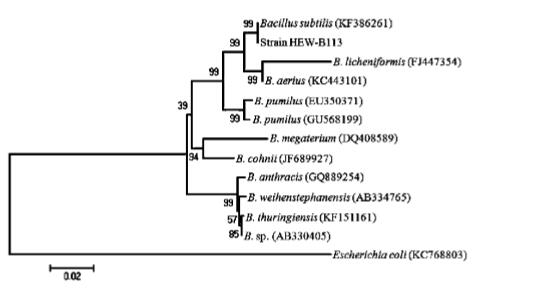
图3 菌株 HEW - B113 系统发育分析
2.2 菌株 HEW - B113 的生长曲线 通过活菌计数绘制枯草芽孢杆菌 HEW - B113 的生长曲线 ( 见图 4) ,当枯草芽孢杆菌 HEW -B13 刚接入培养基中的前1 h,菌体生长缓慢,一 直处于平稳状态,到 1 h 时菌体开始增加,从 1 h 后菌体迅速呈对数生长,由此可以判定0 ~1 h 为延 滞期; 当菌体生长到 4 h 后由于培养基中成分基本 被利用,菌体的生长减慢,到 5 h 后菌体量基本不 再增加,由此可以判定 1 ~ 5 h 为枯草芽孢杆菌 HEW - B13 的对数生长期; 5 h 开始培养基中的菌 体量基本趋于平稳,到11 h 后培养基中菌体量开始 下降,由此可以判定 5 ~11 h 为稳定期,11 h 后枯 草芽孢杆菌 HEW - B13 的生长进入衰亡期。由生长 曲线可知1 ~5 h 为枯草芽孢杆菌 HEW - B13 的对 数生长期,在对数生长期内,菌体生长活性最强, 最适合做种子液,通过试验时间考虑,我们选取 5 h时的发酵培养液作为下一步发酵培养的种子液。
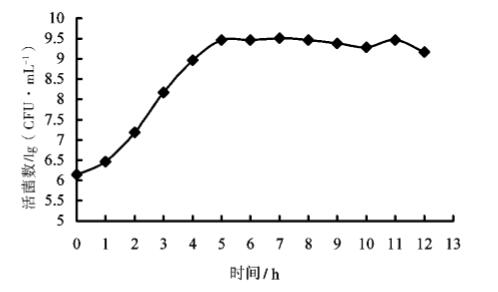
图4 枯草芽孢杆菌 HEW -B113 生长曲线
2.3 菌株 HEW - B113 发酵培养基单因素试验结果
2.3.1 碳源优化结果 通过48 h 发酵后,检测各碳源对枯草芽孢杆菌 HEW - B113 活菌数和芽孢数的影响结果见图4,可 见葡萄糖为最适碳源,其活菌数和芽孢数分别为25 亿 CFU/mL 和 6. 8 亿 CFU/mL,其次为玉米淀粉, 其活菌数和芽孢数分别为 23 亿和 7. 5 亿 CFU/mL。 考虑到实际生产应用选取玉米淀粉和葡萄糖复配作 为下一步研究的碳源,玉米淀粉和葡萄糖比例 为2∶1。
2.3.2 氮源优化结果 通过48 h 发酵后,检测各氮源对枯草芽孢杆菌 HEW -B113 活菌数和芽孢数的影响结果见图5,从活 菌数看,豆粉为最适氮源,其活菌数和芽孢数分别为 47 亿和27 亿 CFU/mL; 从芽孢数看酵母膏为最适氮 源,其活菌数和芽孢数分别为45 亿和36 亿CFU/mL;从芽孢率看酵母膏为最适氮源,由营养成分组成及 成本看,选取豆粉和酵母膏为最适氮源,其分配比 例为3∶1。
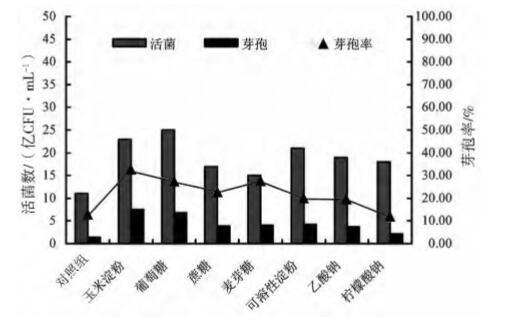
图4 枯草芽孢杆菌 HEW - B113 碳源筛选结果

图5 枯草芽孢杆菌 HEW - B113 氮源筛选结果
2.3.3 无机盐优化结果 通过48 h 发酵后,检测各无机盐对枯草芽孢杆 菌 HEW - B113 活菌数和芽孢数的影响结果见图6, 硫酸锰为最适无机盐,其活菌数和芽孢数分别为65 亿和39 亿 CFU/mL,其次为硫酸铁,其活菌数和芽 孢数分别为 44 亿和 32 亿 CFU/mL。考虑到实际生 产应用选取硫酸铁和硫酸锰复配作为下一步研究的 无机盐,硫酸铁和硫酸锰比例分别为1∶1。
2.4 菌株 HEW - B113 发酵培养基正交试验结果 通过48 h 发酵后,检测各发酵液的枯草芽孢杆 菌 HEW - B113 芽孢数,结果见表 3,由表中 R 值 可知各因素对 B113 芽孢数的影响大小依次为 B > A > F > C > E > D,根据 k 值可确定各因素水平的最 佳组合为 A5B3C2D1E5F4,即玉米淀粉 2%、葡萄 糖1%、豆粉1%、硫酸锰02. %和硫酸铁0. 15%。
表3 枯草芽孢杆菌 HEW - B113 培养基正交试验结果
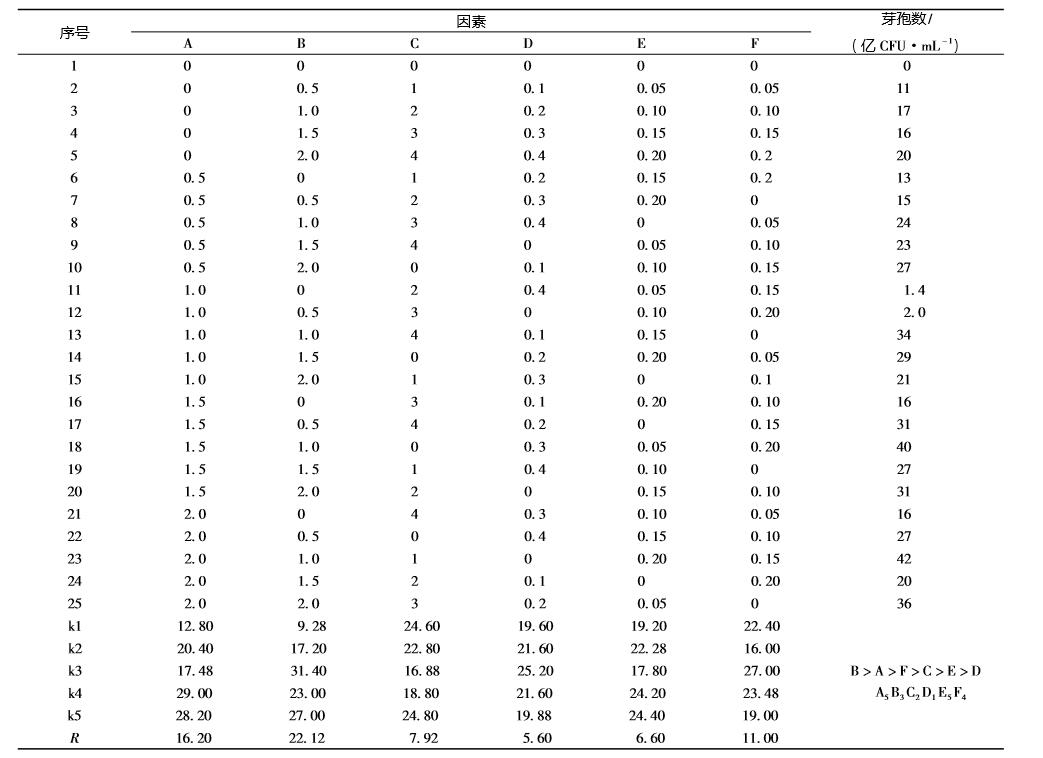
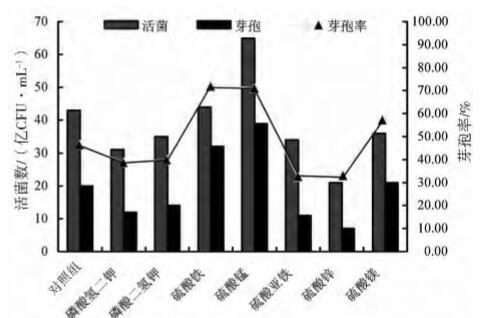
图6 枯草芽孢杆菌 HEW -B113 无机盐筛选结果
2.5 菌株 HEW - B113 发酵条件试验结果 确定最佳发酵培养基的成分之后,对发酵条件 进行逐一优化,获得最优发酵条件。当初始 pH 7. 1、 接种量0. 8%、发酵摇瓶装液量100 mL/500 mL、转 速200 r/min、发酵温度 35 ℃及发酵时间 40 h 时,菌株 HEW - B113 发酵液中的活菌及芽孢数最多, 因此将其作为最优发酵条件。
2.6 验证性试验 运用优化后的发酵条件进行验证试验,至少 3 次重复试验,测发酵液中活菌数及芽孢数。结果均 比对照组高,且存在显著性差异。由此可见验证试 验结果均高于正交试验的各试验组,并且重复性 好,说明该发酵条件是较优条件。
3 讨论 益生芽孢杆菌可产生脂肽、肽、磷脂、多烯、 氨基酸和核酸等多种抑菌物质,具有广谱抑菌活 性,绿色无污染。目前芽孢杆菌类是研究比较广泛 的一类防治疫病的微生物。已有很多研究表明,益 生芽孢杆菌可应用于畜牧养殖中,能够颉颃病原微 生物、增强机体的免疫力及提高养殖的经济效益。 研究从健康猪肠道中分离获得一株芽孢杆菌 HEW - B113,通过细菌鉴定的方法 如形态学、生理生化和分子生物学法鉴定,最终确 定其为枯草芽孢杆菌,并对其发酵培养基成分及发 酵条件进行优化,最终获得 HEW - B113 的最优发 酵培养基为玉米淀粉2%、葡萄糖 1%、豆粉 1%、 硫酸锰0. 2%和硫酸铁 0. 15%; 最佳发酵条件为初 始 pH 7. 1、接种量 0. 8%、发酵摇瓶装液量 100 mL/500 mL、转速 200 r/min、发酵温度 35 ℃及发 酵时间40 h。研究为优良益生菌的筛选提供了丰富 的菌株来源,为进行菌株的耐酸碱、耐胆盐、益生 特性及安全性等研究奠定了基础。
参考文献:
[1]Duc LH,Hong HA,Barbosa TM,et al. Characterization of bacillus probiotics available for human use[ J]. Appl. Enviro. Microbiol. ,2004, 70(4):2161 -2171.
[2]窦茂鑫,赵迪,王蕾,等. 猪源枯草芽孢杆菌的分离 鉴定及生物学特性研究[ J] . 养殖与饲料,2012(4): 11 -14.
[3]Hoa N T,Baccigalupi L,Huxham A,et al. Characterization of Bacillus species used for oral bacteriotherapy and bacterioprophylaxis of gastrointestinal disorders[ J]. Applied and Environmental Microbiology, 2000, 66(9):5241 -5247.
[4]Himanen J P,Pyhl L,Olander R M,et al. Biological activities of lipoteichoic acid and peptidoglycan - teichoic acid of Bacillus subtilis 168( Marburg) [ J]. Journal of general microbiology,1993,139(11) : 2659 - 2665.
[5]姜云,尹望, 陈长卿, 等.人参内生颉颃细菌NJ13 的鉴 定及发酵条件[ J] . 农药,2013, 52(2):97 -101.
[6]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M] . 北 京:科学出版社,2001:353 -398.
[7]布坎南 R E,吉本斯 N E. 伯杰氏细菌鉴定手册 [ M] . 北京:科学出版社.
[8]姜云,尹望,陈长卿,等. 人参内生可培养细菌16S rDNA - RFLP 分析[ J] . 东北林业大学学报,2012, 40(8):34 -39.
[9]Tamura K,Dudley J,Nei M,et al . MEGA4: Molecular Evolutionary Genetics Analysis( MEGA) Software Version 4. 0[ J]. Molecular Biology and Evolution, 2007, 24(8):1596 -1599.
[10]魏姗姗,马红霞,高云航,等. 猪源益生枯草芽孢 杆菌的分离鉴定及培养条件优化[ J] . 中国饲料, 2014(5):21 -25,28.



