一株来自泡菜汁中的 酵母菌分离鉴定
杜志琳 尹望
(北京好实沃生物技术有限公司,北京 101399)
摘 要:为丰富酵母菌菌种来源,研究从泡菜汁中分离获得 1 株疑似酵母菌,并对其编号。通过形态特 征、生理生化鉴定和 18S rDNA 分子鉴定 3 种方法鉴定分离获得 1 株菌。结果表明,分离获得的菌株为毕赤 酵母 HEW - C206。
关键词: 泡菜汁; 酵母菌; 分离鉴定
多年以来,人们为了保障动物健康、预防突发疾病及提高饲料利用率,将防腐剂和抗生素等应用 在动物饲料中,为畜牧业的发展做出了巨大贡献。 但长期使用抗生素等添加剂使动物肠道微生态平衡 失衡,导致动物免疫力下降,甚至发病或死亡等, 从而严重制约了畜牧业的发展。目前,国际上各国 已经严格限制抗生素等添加剂的使用量。这就促使 人们去寻找并开发绿色无污染的饲料添加剂,于是 微生态制剂就应运而生,并慢慢发展起来了。国内 外普遍使用的微生态制剂有乳酸菌类、酵母菌类、 芽孢杆菌类及曲霉类等单一菌制剂和复合菌制剂。 酵母菌是单细胞真核微生物,是人和动物肠道 的主要菌群之一,具有繁殖快、易培养及产率高等 特性,其菌体细胞含有丰富的氨基酸、多肽、微量 元素及维生素等。大量研究表明,饲料中添加酵母 菌及其发酵物,可提高反刍动物瘤胃中的洗涤纤维 的消化率和总挥发性脂肪酸的质量浓度等。酵母及 其培养物可提高瘤胃微生物蛋白质产量,还能够提 高奶牛干物质采食量,并增强消化能力,最终起到 提高动物生产性能的作用,不同菌株的酵母添加剂 的作用效果差异很大。酵母菌剂还可以为新生仔猪提供蛋白质,抑制病原菌的繁殖,刺激有益菌生 长,提高免疫力,减少仔猪腹泻及死亡。酵母菌应 用于水产养殖,不仅可以提高鱼的成活率,可以增 质量,增强鱼苗抵抗力,还可以提高鱼类对食物的 利用率。随着人们对酵母菌研究的深入及现代生物 技术的发展,将会进一步挖掘新型的酵母菌,并广 泛地应用于食品、饲料添加剂和生物医药等领域。 研究通过从自制泡菜汁中分离获得酵母菌,并鉴定 分离获得的菌株,旨在丰富酵母菌菌种库,为酵母 菌的研究提供菌种来源。
1 材料与方法
1.1 材料
1.1.1 分离材料 自制泡菜汁作为分离菌种的材料。
1.1.2 菌种 毕赤酵母菌购自中科院微生物菌种保藏中心,作为 生理生化鉴定中的模式菌株,在PDA培养基上培养。
1.1.3 供试主要培养基和试剂 PDA 培养基,YPD + 硫酸链霉素培养基,YPD 培养基等; 酵母菌 18S rDNA PCR 扩展引物 EF3: ( 5' - TCCTCTAAATGACCAAGTTTG - 3 ') 和 EF4: ( 5'- GGAAGGGRTGTATTTATTAG - 3') 由上海生 物工程有限公司合成。巯基乙醇、dNTP、TaqDNA 聚合酶和酵母菌DNA提取盒等均购自生物工程
表1 主要仪器设备

( 上海) 有限公司,其他试剂均为国产分析纯试剂。
1.1.4 试验仪器 主要试验仪器见表1。
1.2 方法
1.2.1 酵母菌的分离纯化 取自制泡菜汁,用灭菌氯化钠注射液稀释到 10 -4,取100 μL 涂布于 YPD + 硫酸链霉素培养基 平板上,28 ℃培养 24 ~ 48 h 后,采用四分区划线 法,挑取具有典型酵母菌菌落特征的菌落在PDA 培 养基平板上进行2 ~ 3 次纯化培养,经 24 - 48 h 培 养后,挑取分离效果较好的菌株,经镜检为纯种 后,用接种环接种于斜面上 ( PDA) 进行纯培养, 于4 ℃冰箱保存备用。
1.2.2 形态特征鉴定
1.2.2.1 酵母菌菌落形态观察 固体培养的菌落形态: 将斜面保藏的菌种接种 到 PDA 平板上,于28 ℃培养48 h,观察菌落形状、 大小、边缘、颜色、质地和湿润程度等。 液体培养的菌落形态: 将斜面保藏的菌种接种 到 PDA 液体培养基中,于28 ℃摇床震荡培养24 h, 观察发酵液状态,菌液是否有浑浊现象,液面是否 有菌醭或菌岛,底层是否有沉淀,培养基的颜色, 随时记录现象。
1.2.2.2 酵母菌个体形态观察 用灭菌接种环挑取 PDA 固体培养基上单菌落于 载玻片上,用灭菌氯化钠溶液稀释,于100 ×油镜下 观察细胞形态,记录菌体形状、假菌丝及繁殖方式。
1.2.3 生理生化鉴定 参照巴尼特的 《酵母菌的特征与鉴定手册》和 C P Kurtzman 等及 Kreger - van Rijetal 等的酵母分类 体系 ( 第4 版) 中的酵母菌的生理生化鉴定的试验 要求进行鉴定。
1.2.4 18S rDNA 分子鉴定 通过生理生化试验初步筛选出的酵母菌进行基因
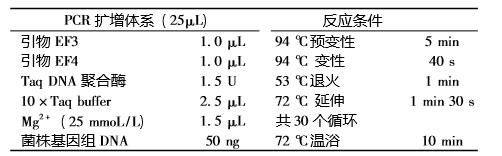
组DNA 鉴定,用酵母菌 DNA 提取试剂盒提取酵母 DNA,通过引物EF3 和EF4 对疑似酵母菌的18S rDNA 基因片段进行 PCR 扩增,PCR 扩增体系 ( 25 μL) 及反应条件见表2,电泳检测 PCR 产物,并回收纯 化 PCR 产物,在中科院微生物所测定疑似酵母菌 DNA 序列。将所得序列与 GenBank 中的 18S rDNA 序列进行 BLAST 比对,获得相似的序列与系统发育 相关的物种,用 MEGA 5. 0 软件构建系统发育树进 行系统发育分析。
表2 酵母菌的 PCR 扩增体系 (25 μL) 及反应条件
2 结果与分析
2.1 酵母菌的初步分离 试验取鲜艳泡菜汁,稀释后涂布于含有硫酸链 霉素的YPD 培养基上,将具有酵母菌典型特征的菌 落进行了分离纯化,并通过镜检初步确定其复合酵 母菌的细胞及形态特征,共分离纯化出 2 株菌,并 分别编号为 HEW - C206 和 HEW - C107。
2.2 菌株形态及培养特征 2 株菌的液体培养特征基本相似,都未出现菌 醭和菌岛,但底部均有白色絮状沉淀物; 固体培养 时,在平板上菌落呈圆形,边缘整齐,白色或乳白 色,不透明,直径约 1 ~4 mm,菌落质地均匀,表 面光滑、湿润且黏稠,易挑起,并伴有发酵香气。 各菌株的细胞形态呈椭圆形,生殖方式是芽殖,没 有假菌丝产生。
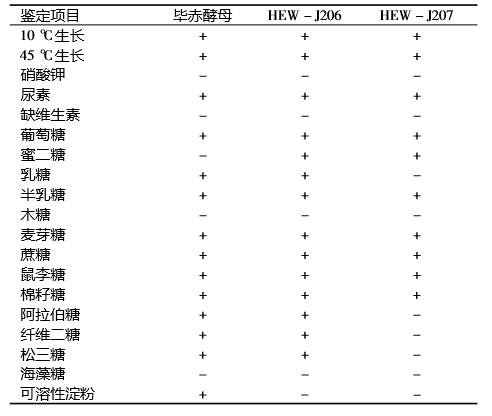
2.3 生理生化鉴定结果 分离获得的2 株细菌生理生化鉴定结果见表3。 2 株菌均可以在 10 和 45 ℃下生长,通过与酵母菌模式菌株毕赤酵母比较可初步鉴定 HEW - C206 和 HEW - C107 为酵母菌,并且菌株 HEW - C206 初步 鉴定为毕赤酵母。
表3 分离菌的主要生理生化特征
2.4 18S rDNA 分子鉴定结果 通过对菌株HEW -C206 的基因组DNA 进行18S rDNA PCR 扩增。结果表明: PCR 扩增获得菌株 HEW - C206 的 18S rDNA 片段,片段大小均在 1 500 bp左右见图1。对获得的18S rDNA PCR 产物进 行测序,获得菌株 HEW - C206 的 18S rDNA 序列, 大小分别为1 442 bp。用 MEGA5. 0 构建系统进化树 见图2。可以看出菌株 HEW - C206 与毕赤酵母聚于 同一分支,同源性均达到了99%。通过菌株 HEW - C206 的形态特征、生理生化反应及18S rDNA 序列分 析,确定菌株 HEW -C206 为毕赤酵母。
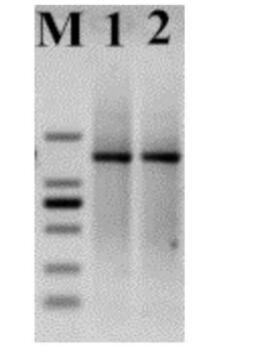
注: M 为 DL2000 ladder,1 为酵母菌模式菌株; 2 为 HEW - C206。 图1 18S rDNA 基因 PCR 扩增电泳结果
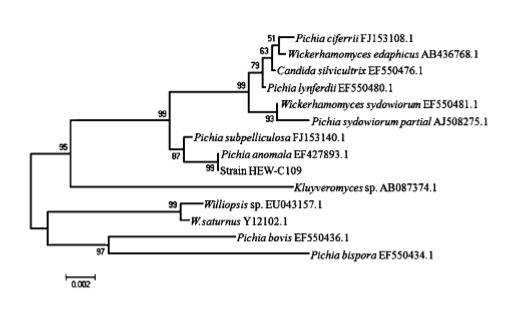
图2 酵母菌和其他参考株18S rDNA 序列的系统进化树
3 讨论 健康的动物肠道内存在大量的正常菌群,主要 是以乳酸杆菌和双歧杆菌等肠道专性厌氧菌为优势 菌的肠道菌群,稳定的肠道群系能协助动物产生免 疫反应。肠道微生物协同作用,抑制病原微生物的 生长繁殖,同时促进肠道功能的完善。酵母菌是动 物肠道菌群的一种共生菌,可有效降低消化道中的 大肠杆菌数,并调节肠道菌群平衡。不但解决了滥 用抗生素所产生的残留问题,还能够促进动物饲料 的消化率。研究通过选择培养基从泡菜汁中分离获 得了1 株疑似酵母菌的菌株,通过形态学鉴定、生 理生化鉴定和18S rDNA 分子鉴定,发现其为毕赤酵母 菌。研究获得的酵母菌通过发酵及后处理加工,可作 为饲料添加剂应用于动物,无毒、无污染且安全。 酵母菌作为一种绿色、安全及有效的饲料添加 剂,现已被广泛运用到畜牧业生产中,对其研究已 经成为当今的热点。在国外,有关酵母菌的研究报 道较多,在我国近几年才刚刚兴起,因此对酵母菌 的研究和认识还不够,还需要进一步的深入。酵母 菌能够为动物提供蛋白质,抑制肠道病原菌的繁 殖,刺激有益菌的生长,提高免疫力和抵抗力,减 少腹泻及死亡。研究只是对分离获得的菌种进行了 鉴定,将对其他益生性能做进一步研究,深入探讨 这株酵母菌的益生性,并应用在动物微生态制剂 中,这需要动物饲养试验才能确定。研究为日后新 型酵母菌饲料添加剂及酵母菌菌种的选择等的研究 提供了基础。
参考文献
[1]石现瑞,高峰. 抗生素添加剂的负面效应及其替代 品的研究[ J] . 饲料博览,2000(3):24-26
[2]卢春芳,刘国娟,刘大程,等. 6 株酵母菌产营养活 性物质能力的比较分析[ J] . 动物营养学报,2014, 26(2): 533 -540. [3]孙鸽. 奶牛微生态制剂酵母菌优良特性的研究及 其对瘤胃发酵的影响[ D] . 呼和浩特: 内蒙古农业 大学,2012.
[4]Piva G,Belladonna S,Fusconi G,et al. Effects of yeast on dairy cow performance,ruminal fermentation,blood components,and milk manufacturing properties[ J]. Journal of Dairy Science,1993, 76(9): 2717 -2722.
[5]甄玉国. 饲用微生态制剂———酵母培养物及其在反 刍动物中的应用[ J] . 饲料工业,2005, 26(1): 5 -9.
[6]王聪,黄应祥,刘强. 酵母及其培养物在奶牛业中 的应用研究进展[ J] . 江西畜牧兽医杂志,2005(1): 25 -26.
[7]Chaucheyras -Durand F,Walker N D,Bach A. Effects of active dry yeasts on the rumen microbial ecosystem: past,present and future[ J]. Animal Feed Science and Technology,2008,145( 1/2/3/4) : 5 -26.
[8]张青. 几种微生态制剂预防仔猪腹泻的效果[ J] .青海畜牧兽医杂志,2010, 40(3): 7 -8.
[9]Mohanty S N,Swain SK,Tripathi S D. Rearing of catla( Catla catlaHam. ) spawn on formulated diets [ J] . Aquaculture in the Tropics ,1996(11) : 253 -258.
[10]Tovar D,Zambonino J,Cahu C,et al. Effect of live yeast incorporation in compound diet on digestive enzyme activity in sea bass( Dicentrarchus labrax) larvae [ J]. Aquaculture,2002(204) : 113 -123.
[11]陈生龙. 活酵母对断奶仔猪生产性能、免疫功能 和肠道微生物区系的影响[ D] . 福州: 福建农林 大学,2009.
[12]魏亚松,刘慧芳,邹玲,等. 水貂肠道酵母菌的分 离鉴定及系统发育分析[ J] . 中国农学通报, 2013, 29(5): 30 -36. [13]赵龙飞, 徐亚军, 梁峰. 茶酒酿造过程中酵母菌的分 离和鉴定[ J] . 中国酿造,2010,223(10) : 65 -68.
[14]王富根. 酵母菌在饲料与动物生产中的应用[ J] . 当代畜牧,2013, (32) : 77 -78.



