丁酸对脂肪代谢的调节及其作用机制
摘要:丁酸作为肠道菌群发酵产物之一,不仅可为生物体提供能量,还能以信号分子形式调节体内能量和物质代谢。近年来,在饲粮中添加丁酸能够有效减少动物过多脂肪沉积而受到广泛关注,然而一些研究发现丁酸表现出促进脂肪合成的作用。丁酸一方面作为脂肪合成的底物,另一方面以信号分子形式即通过结合G蛋白偶联受体(GPCRs)或者抑制组蛋白去乙酰化酶(HDACs)的活性来调节脂肪代谢。本文主要从这2方面来探讨丁酸与脂肪代谢之间的联系,为畜禽养殖中如何减少过多脂肪沉积或抑制肥胖提供理论参考。
关键词:丁酸;脂肪代谢;G蛋白偶联受体;组蛋白去乙酰化酶;肥胖
人群中肥胖的流行及危害性已引起全世界密切关注,而动物乳脂合成、腹脂沉积等生产表现也一直备受畜禽行业研究者关注。近年来,随着高通量测序技术发展,肠道微生物结构与功能不断被揭秘,大量研究证明微生物与宿主脂肪代谢存在密切联系,尤其是微生物主要发酵产物短链脂肪酸(SCFAs)在其中扮演着重要的角色。丁酸作为SCFAs的一种,能够预防和治疗动物肥胖的发生。Fang 等通过饲喂小鼠丁酸钠可调节肠道菌群的组成并改善高脂饮食诱导的肥胖;赵利芹在饲粮中添加丁酸钠能够减少肉鸡脂肪沉积;在肥胖男性结肠中灌注丁酸钠后,静息能量消耗和空腹脂肪氧化都得到增加。然而,一些研究发现,丁酸有利于促进人和动物体内的脂肪合成,而且肥胖人个体粪便中的丁酸含量明显高于正常个体。丁酸一旦被机体吸收可以满足结肠大部分所需能量,部分丁酸经门静脉进入肝脏作为脂肪生成的底物,也可到达乳腺组织合成乳脂,而且在体外可诱导前脂肪细胞分化成脂肪细胞。为更进一步探究丁酸与脂肪代谢之间关系,本文对丁酸调节脂肪代谢的作用机制进行综述,为微生物及其产物丁酸调控脂肪代谢提供指导。
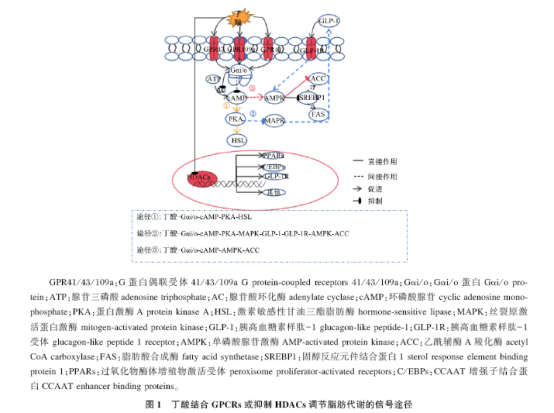
丁酸为肠道(主要是结肠)细胞提供能量,也可作为底物参与脂肪合成,同时又以信号分子形式,被细胞表面GPCRs识别,激发下游通路,进而调控脂肪代谢。
综上所述,作为信号分子,丁酸可以结合GPCRs来调节脂肪代谢,并且表现出对脂肪合成既可促进又可抑制的两面性特征。
作为信号分子,除了结合GPCRs之外,丁酸是一种天然的HDACs抑制剂,丁酸可以增加组蛋白乙酰化程度,松散染色质结构,从而有利于提高脂肪代谢有关的基因转录水平,进而调控脂肪代谢。