丁酸梭菌益生性及抗逆性研究
摘要:本研究以一株丁酸梭菌C-101作为实验菌株,从抑菌能力,耐热性,耐人工胃液,人工肠液,人工胆盐能力几个方面,分析了其作为微生态制剂菌种的潜力,实验结果可知,该菌株耐热性良好,80摄氏度处理5min,存活率仍达到99.0%,人工胃液处理2h,存活率87.8%,人工肠液处理2.5h,存活率98.9%,0.4%胆盐处理,生长情况良好,能够抑制常见的致病菌:大肠杆菌,沙门氏菌,金黄色葡萄球菌,单增李斯特菌,益生性能优良,可以作为微生态菌剂开发菌种。
关键词:微生态制剂,益生性,抗逆性
丁酸梭菌(Clostridium butyricum)属于厌氧革兰氏阳性菌,电子显微镜下观察其菌体形态呈直或略有弯曲的杆状,单个或成对,部分呈丝状,短链,白色略带灰感,细菌直 径为(0.6~1.4)×(2.7~7.3)μm,菌体中间略饱满,两端呈 钝圆形,周身有鞭毛,具运动性[1],广泛存在于奶酪、天然酸奶、酒窖泥、土壤及人与动物粪便中[2]。丁酸梭菌代谢过程中主要产物为丁酸,在反刍动物肠道中,丁酸能够被结肠上皮细胞代谢利用并产生能量。做为产芽孢菌,丁酸梭菌具有耐热、耐酸、耐多种抗生素等能力[3],可调节动物肠道内的微生态平衡,具有调整肠道功能的作用。丁酸梭菌还具有抗癌、提高机体免疫力、抗氧化等作用,目前已被制成微生态制剂广泛地用于保健食品[4]。
2009年丁酸梭菌被农业部批准,允许作为活菌制剂在饲料中添加。微生态制剂能否作为活菌制剂被应用,取决于菌种的益生性能,以及其在后续加工过程中的抗逆性,能够保证微生态制剂有效活菌数及产品的稳定性。丁酸梭菌作为一种梭状芽孢杆菌,具有一定耐高温、耐动物胃肠道环境的能力,但是这些特性在不同菌株之间存在较大的差异。所以,研究丁酸梭菌的益生性能及抗逆性显得尤为重要,本研究中,以实验室筛选得到的一株丁酸梭菌C-101为实验菌株,研究了其高温耐受能力,抑菌能力,耐胃酸,耐胆盐能力,为该菌株的应用提供了理论基础。
1. 实验材料与方法
1.1菌株
丁酸梭菌C-101:由好实沃生物保藏提供。
指示菌:大肠埃希氏菌(Escherichiacol),金黄色葡萄球菌(Staphylococcus aureus),单核细胞增生李斯特菌(Listeria Monocytogenes,肠炎沙门氏菌(S. enteritidis)。
1.2实验材料
强化梭菌培养基(reinforced clostridial medium,RCM)、LB琼脂培养基、胰蛋白胨大豆琼脂(tryptic soy agar,TSA)培养基。
种子培养基:RCM液体培养基。
丁酸梭菌发酵培养基:蛋白胨 10.0 g,牛肉粉 10.0 g,酵母粉3.0 g,葡萄糖5.0 g,可溶性淀粉1.0 g,L-半胱氨酸盐粉 3.0 g,磷酸氢二钾 0.05 g,硫酸镁0.08 g,硫酸锰0.002 g,纯化水1000 mL,pH 7.0[5]。
以上培养基制备完成后均需高压灭菌备用,灭菌温度121℃,灭菌时20min。
人工胃液,人工肠液的配制参照《中国药典》。
1.3 实验方法
1.3.1抑菌能力实验
菌种准备:将甘油管保藏的丁酸梭菌C-101 0.1 mL接种到10 mL液体RCM培养基中,厌氧培养18 h,备用。将活化好的菌株接种于种子培养基,厌氧培养24 h,再按5%接种量,接种于发酵培养基,37℃厌氧培养48h后备用。
将大肠杆菌、沙门氏菌划线接种于LB固体培养基上37 ℃培养24 h, 依次用无菌生理盐水洗脱菌体,制备菌悬液,并将菌悬液的菌浓度稀释为106CFU/mL,备用。
将金黄色葡萄球菌、单核细胞增生李斯特菌接种于TSA固体培养基上,于37 ℃条件下培养24 h,依次用生理盐水洗脱,制备菌浓度为106CFU/mL左右的菌悬液后,备用。
指示菌平板的制备:采用双层平板法制备指示菌平板。取15 mL培养基加入到培养皿,凝固后作为下层;取5 mL含2%不同指示菌菌悬液的培养基加入凝固后的下层培养基上作为上层,待用。
采用牛津杯法测定抑菌活性。在牛津杯中加入200 μL丁酸梭菌发酵上清液,于37 ℃条件下 培养16~18 h,观察并测量抑菌圈直径。每组测定两个重复。
1.3.2 菌悬液的制备
将活化好的菌株C-101种至种子培养基中,37 ℃厌氧培养24 h后,按5%接种量接种至发酵培养基,37 ℃厌氧培养48 h,发酵培养结束后,3 000 r/min离心10 min,收集菌体,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤两次后重悬,使菌体浓度为4.5×108CFU/mL,备用。
1.3.3耐热性试验
取上述菌液样品1 mL到含9 mL甘油溶液(80%甘油)的试管中,充分混匀,分别置于60 ℃、70 ℃、80 ℃、 90 ℃、100 ℃的水浴中处理5 min,置于0 ℃冰水混合物中冷却,3000 r/min离心10 min,收集菌体,PBS洗涤两次后重悬,采用梯度稀释平板法测定其活菌数,每个样品重复3次,计算存活率,其计算公式如下:
存活率=处理后活菌数/处理前活菌数×100%
1.3.4人工胃液耐受性试验
取上述样品菌液1 mL到9 mL人工胃液中,人工胃液最终pH值调为1.5左右,振荡混匀,37 ℃水浴,每隔0.5 h取样,将经过人工胃液处理后的菌悬液,3000 r/min离心10 min,PBS洗涤两次后重悬,梯度稀释法进行计数,每个样品3个平行,计算存活率。
1.3.5人工肠液耐受性试验
取上述样品菌液1 mL到9 mL人工肠液中振荡混匀, 37 ℃水浴2.5 h,毎隔0.5 h取样,3 000 r/min离心10 min, PBS缓冲液洗涤两次后重悬,采用梯度稀释法进行活菌计数,每个样品3个平行,计算存活率。
1.3.6胆盐耐受性试验
在RCM液体培养基中加入不同浓度的猪胆盐,使其浓度分别为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%,混匀,121 ℃、 15 min灭菌后备用。按107 CFU/mL接种量分别接种丁酸梭菌C-101,厌氧培养24 h,检测活菌数,每个样品重复3次。
2. 实验结果与讨论
2.1 抑菌实验
丁酸梭菌代谢产生的有机酸能够降低肠道pH,同时产生细菌素,抑制肠道中致病菌的生长,丁酸梭菌对常见致病菌抑制能力结果如表1所示,结果显示,丁酸梭菌C-101对常见致病菌具有显著抑制能力,由于其产生的抑菌物质非单一有机物,所以,其抑菌物质仍待进一步的研究。
表1 C-101对常见致病菌抑菌效果
|
指示菌 |
大肠杆菌 |
金黄色葡萄球菌 |
沙门氏菌 |
单增李斯特菌 |
|
抑菌圈直径/mm |
17.01 |
15.21 |
17.02 |
11.36 |
3.2 耐热性实验
由表2可知,丁酸梭菌C-101具有良好的耐热性,80摄氏度处理5min后,存活率仍可达99.5%,温度继续升高,存活率下降,对于饲料加工过程,需缩短热处理时间。
表2 C-101耐热性能
|
实验组 |
热处理温度 |
||||||
|
对照 |
50 |
60 |
70 |
80 |
90 |
100 |
|
|
活菌数×107cfu/ml |
4.5 |
4.48 |
4.48 |
4.48 |
4.45 |
3.35 |
2.20 |
|
存活率% |
100 |
99.5 |
99.5 |
99.5 |
99.0 |
74.4 |
48.9 |
2.3人工胃液耐受性
表3 C-101人工胃酸耐受性
|
实验组 |
处理时间h |
|||||
|
对照 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
|
|
活菌数×107cfu/ml |
4.50 |
4.50 |
4.41 |
4.01 |
3.95 |
3.90 |
|
存活率% |
100 |
100 |
98.0 |
89.1 |
87.8 |
86.7 |
动物胃液为酸性,pH一般在2.5-3.0[6],微生态制剂能否达到肠道发挥效应,需经过胃液,并保持一定的活性,由表3可知,丁酸梭菌经人工胃液处理后2.5h后活菌数仍能够保持较高水平,活性降低13.3%,性状优良,可以作为微生态制剂生产用菌种。
2.4人工肠液耐受性
表4 C-101人工肠液耐受性
|
实验组 |
处理时间h |
|||||
|
对照 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
|
|
活菌数×107cfu/ml |
4.50 |
4.50 |
4.50 |
4.50 |
4.45 |
4.45 |
|
存活率% |
100 |
100 |
100 |
100 |
98.9 |
98.9 |
由表4可知,丁酸梭菌C-101对人工肠液具有很好的耐受性,人工肠液处理2.5 h,活菌数均为 4.45×108 CFU/mL,存活率98.9%,说明该菌株在肠道内保持较高的存活率。
2.5 胆盐耐受性
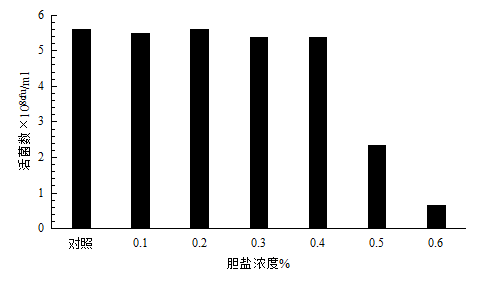
图1 C-101胆盐耐受性
动物肠道内胆盐的质量分数约为0.03%-0.30%,菌株能否在肠道中定植,取决于菌株对胆盐的耐受能力[7]。由图1可知,菌株C-101对胆盐具有很好的耐受性,在人工胆盐浓度0.4%条件下能够正常生长,当胆盐浓度达到0.5%时受到抑制,可以保证其顺利地通过小肠,并最终成功定殖于动物肠道后端。
3. 结论
本研究以实验室分离保藏的一株丁酸梭菌C-101为实验菌株,对其抑菌能力,耐热性,人工胃液,人工肠液,人工胆盐耐受性,实验结果显示,该菌株对常见致病菌由显著的抑制效果,耐热性良好,能够耐受饲料制粒或加工过程的热处理过程,对胃酸,肠液,胆盐耐受性能优良,具有良好的应用潜力。
参考文献
[1] 赵建新,张灏,田丰伟. 丁酸菌的分离、鉴定及筛选[J]. 食品与生物 技术学报,2002(6):597-601,612.
[2] 桂国弘,徐娥,杨华,等.丁酸梭菌调节肠道健康的作用机制 [J]. 饲料研究,2016( 22) : 42-46.
[3] 田召芳,李春蕾,党安坤. 丁酸梭菌作用机理与研究进展[J]. 中国畜禽种业,2017( 8) : 36-38.
[4] 熊祖明,袁杰利. 酪酸梭菌的研究与应用进展[J]. 中国微生态学杂志,2011,23( 12) : 1143-1145.
[5] 谢丽静,王丽,王伟华等,丁酸梭菌优良菌株LXYB-2抑菌活性及抗逆性研究[J],中国酿造,2018,37(6):91-96
[6] 陈桂芳,刘艳,单春乔,等. 费氏丙酸杆菌生物学特性及与5株益生菌拮抗性试验研究[J]. 中国酿造,2018,37(1):69-73.
[7] 张媛媛. 复合芽孢杆菌制剂发酵工艺及其耐受性研究[D]. 哈尔滨:东北林业大学,2012.



